Environ 70% des cancers de l’ovaire sont dits « séreux de haut grade »[2] et présentent un pronostic sévère. Optimiser les traitements et développer de nouvelles stratégies constituent donc des enjeux de scientifiques et médicaux majeurs. Aujourd’hui, les scientifiques s’intéressent à une population cellulaire spécifique : les fibroblastes, des cellules hétérogènes présentes dans l’ensemble de l’organisme au niveau des tissus conjonctifs (qui assurent la cohésion des autres tissus de l’organisme). Les fibroblastes associés au cancer (CAF) participent au maintien du microenvironnement tumoral, considéré comme un moteur important dans le développement de la maladie (par exemple en favorisant la propagation de métastases). Comprendre le rôle et l’évolution des CAF pendant la maladie et son traitement est donc essentiel pour trouver des approches thérapeutiques plus efficaces contre le cancer.
L’effet de la chimiothérapie sur les fibroblastes associés au cancer
Au sein de l’unité Cancer, hétérogénéité, instabilité et plasticité (Inserm, Institut Curie), l’équipe dirigée par le Dr Fatima Mechta-Grigoriou[3], a évalué l’effet d’un traitement par chimiothérapie sur quatre populations de CAF préalablement identifiées dans les cancers ovariens séreux de haut grade. Les chercheuses et chercheurs ont réussi à distinguer plusieurs catégories de CAF : certains, bénéfiques, bloqueraient le développement tumoral, tandis que d’autres, néfastes, participeraient à la croissance du cancer. Les scientifiques ont observé qu’une importante proportion de CAF néfastes est inactivée à la suite d’un traitement par chimiothérapie. Cependant, une proportion variable de ces CAF néfastes reste activée en dépit de la chimiothérapie, avec un impact sur l’efficacité du traitement.
Les CAF et le système immunitaire
L’équipe a voulu aller plus loin et s’est intéressée à l’interaction entre ces CAF néfastes et le système immunitaire. Ses résultats révèlent que la population de CAF néfastes bloque l’activité antitumorale de cellules immunitaires essentielles : les lymphocytes T CD8+. Ainsi, cibler ces CAF néfastes résiduels, en combinaison avec la chimiothérapie, pourrait améliorer le pronostic des patientes atteintes de cancer de l’ovaire.
« Ces résultats suggèrent qu’une approche thérapeutique ciblant spécifiquement ces CAF néfastes résiduels, en complément d’une chimiothérapie, pourrait augmenter l’activité antitumorale des lymphocytes T CD8+ et améliorer le traitement du cancer et le pronostic des patientes » explique le Dr Fatima Mechta-Grigoriou. « A l’Institut Curie, nous menons actuellement le projet de Recherche Hospitalo-Universitaire CASSIOPEIA qui porte sur ces mêmes populations de CAF pour lutter contre les métastases et la résistance au traitement dans les cancers du sein triple négatif. »
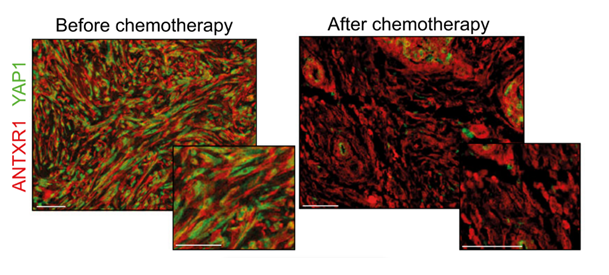
Marquage des populations de CAF néfastes (ANTXR1, en rouge) et de protéines intracellulaires YAP1 (en vert) dans des cellules avant et après traitements. Après la chimiothérapie, on observe la présence résiduelle de YAP1 en vert qui pourrait être ciblée pour augmenter l’efficacité de la chimiothérapie. Barres d’échelle, 50 μm
Les fibroblastes au-delà du cancer
Des résultats publiés récemment[4] par la même équipe ont également mis en évidence un rôle des fibroblastes dans le développement des maladies rénales chroniques, cause majeure de mortalité dans le monde. En s’accumulant, ces fibroblastes induisent des dysfonctionnements rénaux. Les scientifiques ont ainsi montré que la présence au diagnostic de fibroblastes particuliers était prédictive d’un pronostic défavorable chez le patient.
« Les diverses populations de fibroblastes sont impliquées à différents stades du développement pathologique dans le cancer, mais apparaissent aussi de façon nouvelle et intrigante dans d’autres pathologies, ce qui élargit considérablement notre domaine de recherche », conclut le Dr Fatima Mechta-Grigoriou.
|
Référence: Monika Licaj (…) et Fatima Mechta-Grigoriou. Residual ANTXR1+ myofibroblasts after chemotherapy inhibit anti-tumor immunity via YAP1 signaling pathway. Nature Communications, 2024 Feb 12;15(1):1312. doi: 10.1038/s41467-024-45595-3. |
[1]On définit par microenvironnement tumoral, l’ensemble des cellules ou constituants biologiques (vaisseaux sanguins, cellules immunitaires, fibroblastes, molécules de signalisation, matrice extracellulaire) qui sont situés autour des cellules cancéreuses et qui interagissent fortement avec elles.
[2] Le cancer de l’ovaire séreux de haut grade est un sous-type qui se développe à partir des cellules épithéliales.
[3] L’équipe Stress et cancer à l’Institut Curie est dirigée par le Dr Fatima Mechta-Grigoriou, directrice de recherche de classe exceptionnelle à l’Inserm.
[4] Cohen et al., 2024, WNT-dependent interaction between inflammatory fibroblasts and FOLR2+ macrophages promotes fibrosis in chronic kidney disease, Nature Communications, 2024 Jan 25;15(1):743. doi: 10.1038/s41467-024-44886-z.